抗生素的滥用和产生耐药性仍是感染治疗过程中的“瓶颈”问题。光热疗法(PTT)是一种新型的非侵入性治疗技术,在处理耐药细菌方面表现出巨大的潜力。前期研究发现,光热温度越高,对细菌杀伤力越大,抗菌效果越好。光热升温至50℃及以上,可以有效杀灭细菌,抑制耐药菌引发的感染。但局部的过高热(>50℃)会对正常组织造成不可逆的伤害,不利于胶原的沉积和血管化,影响组织愈合。因此,单纯依赖光热疗法治疗感染性组织修复有其局限性。优化单一的光热治疗方案,升级温和光热-光动力联合疗法,发挥1+1>2的效果,再协同抑炎药物控释,改善免疫微环境,是治疗感染性组织修复的有效手段。
为此,设计了一种在光激发下具有光热/光动力/药物控释的多功能复合金纳米花颗粒,在温和光热(~45℃, mPTT)/光动力(PDT)联合治疗下有效抑制感染,协同非缁类抑炎药物调节免疫微环境,促进感染性组织愈合(图1)。
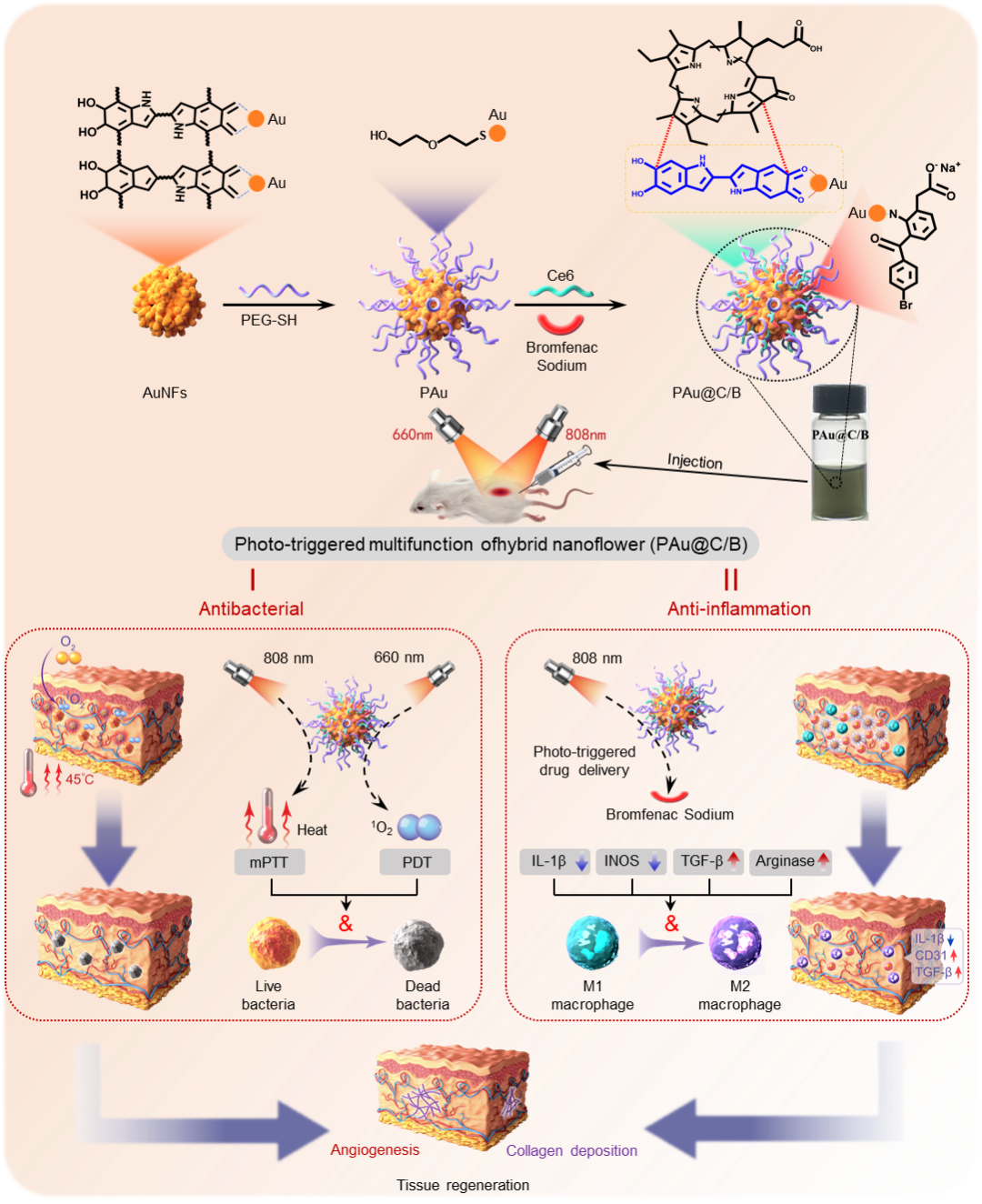
图1 复合金纳米花(PAu@C/B)的合成及促进感染性皮肤组织再生示意图
首先通过课题组首创的“模板法”合成了分散性佳、稳定性好,光热转化效率高的超支化的“蒲公英状”金纳米花颗粒(AuNFs),利用金纳米花表面特殊的官能团及高比表面积的特点,在其上负载了光敏剂(Ce6, PDT)和非缁类抑炎药物(溴芬酸钠/BS),最终形成多功能复合金纳米花颗粒(PAu@C/B)(图2)。在808 激光照射下,PAu@C/B迅速升温,展现出优异的光热性能;660 nm激光照射激发PAu@C/B,在Ce6的作用下生成1O2;最后,在温和光热作用下,NIR发挥“开关”作用,调节抑炎药物的释放行为(图3)。
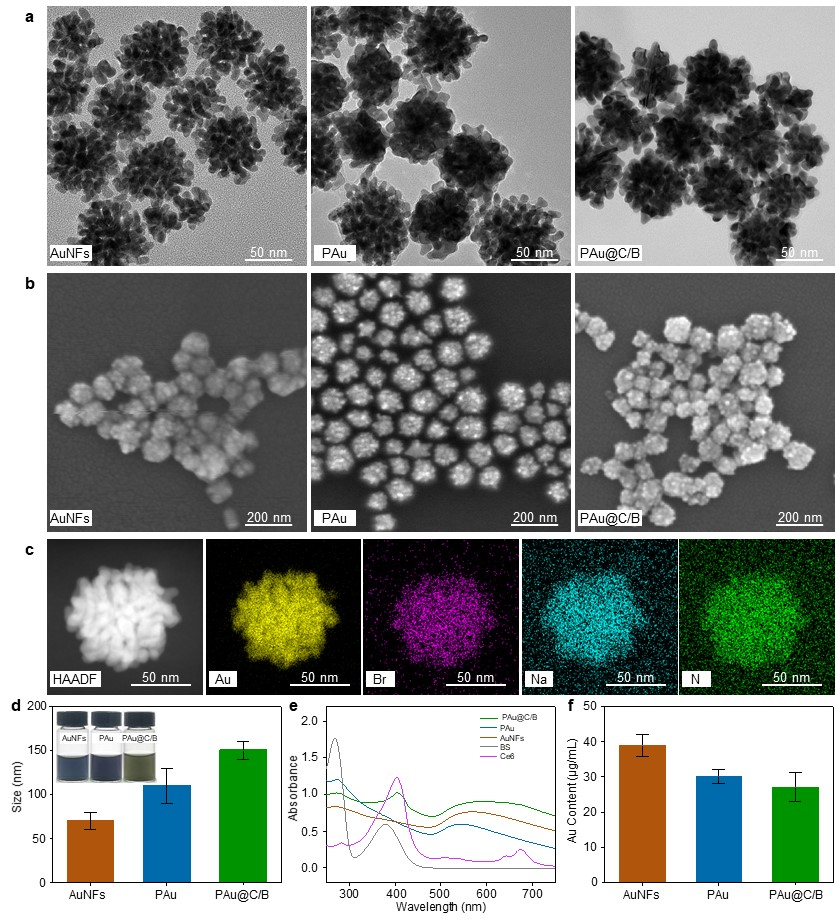
图2 复合金纳米花(PAu@C/B)的表征
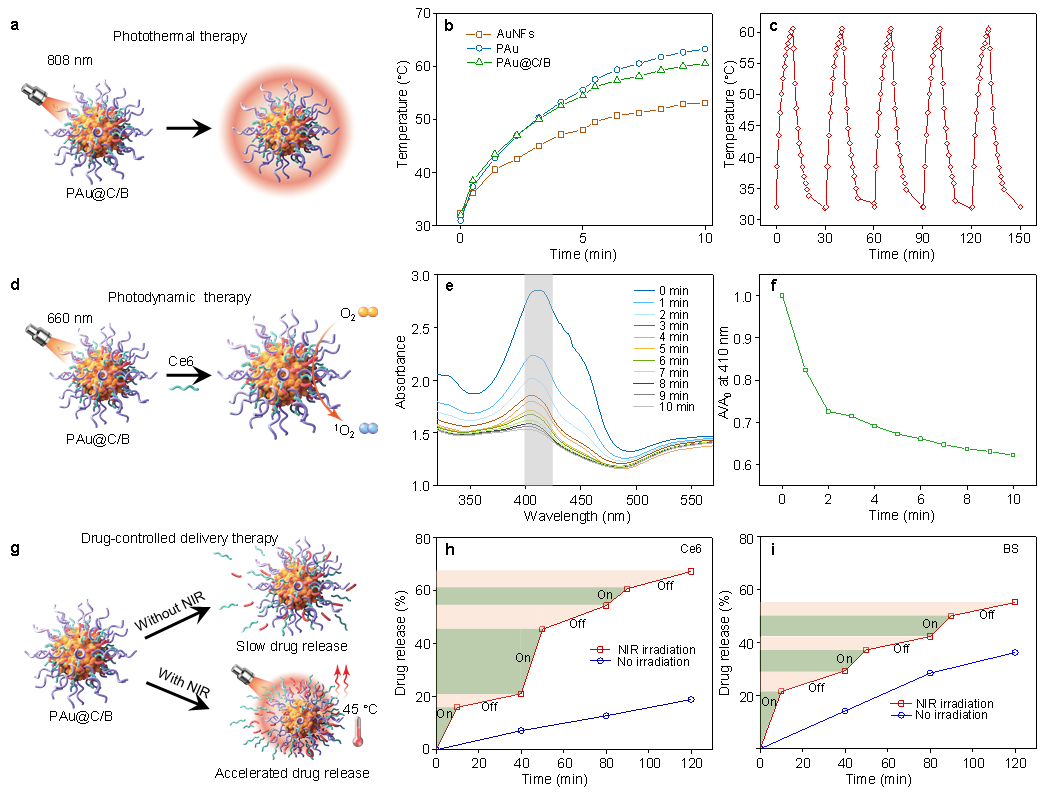
图3 复合金纳米花(PAu@C/B)的多功能性展示
体外抗菌实验证明,温和光热疗法(~45℃, PTT)联合光动力疗法(1O2, PDT)相较于单纯光热或光动力治疗,能够有效抑制细菌生长和生物膜形成,抑菌率和生物膜抑制率达到99%(图4)。
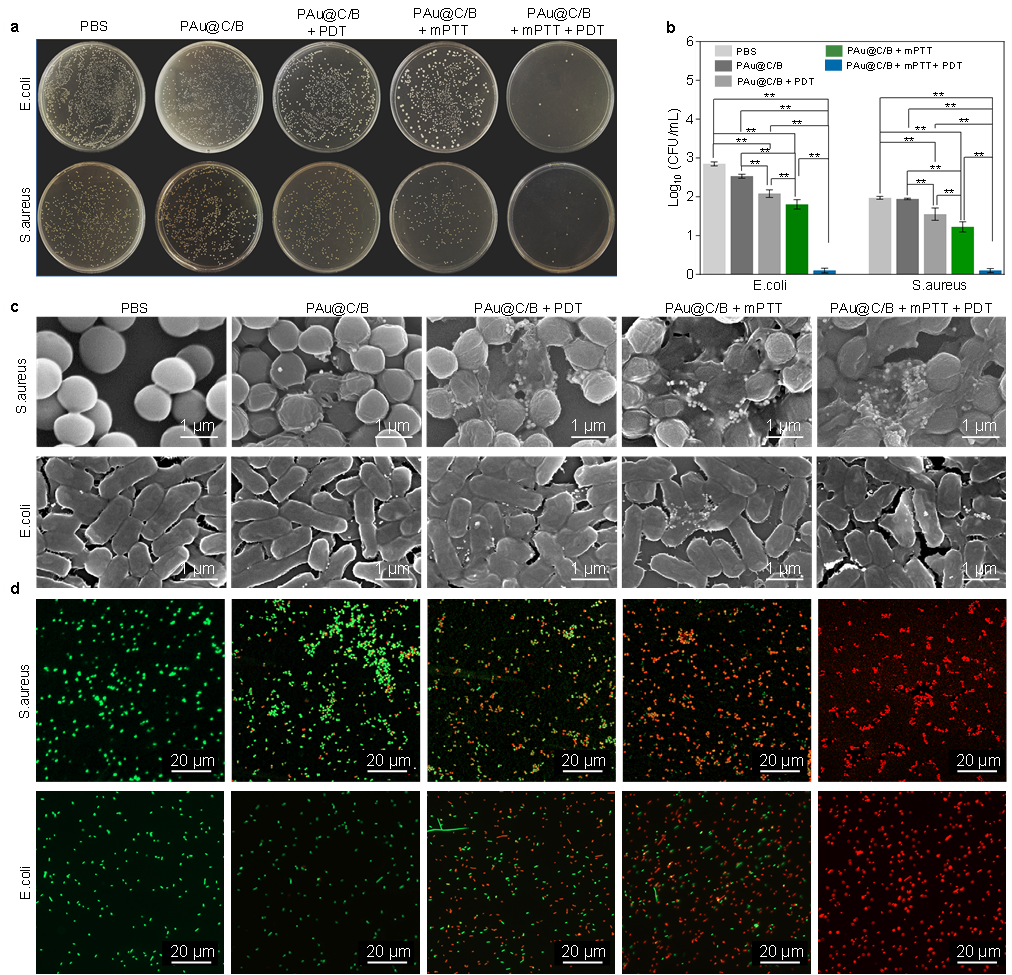
图4 复合金纳米花(PAu@C/B)的体外抗菌活性
构建了MRSA感染的皮下脓肿和皮肤全切模型,在温和光热/光动力作用下有效控制感染;在非缁类抑炎药物溴芬酸钠(BS)的作用下诱导巨噬细胞向抗炎型极化,从而调节了免疫微环境。体内实验证实复合金纳米花在光激发下能够有效抑制感染,促进胶原沉积和血管生成,加速了感染性组织的愈合(图5-6)。
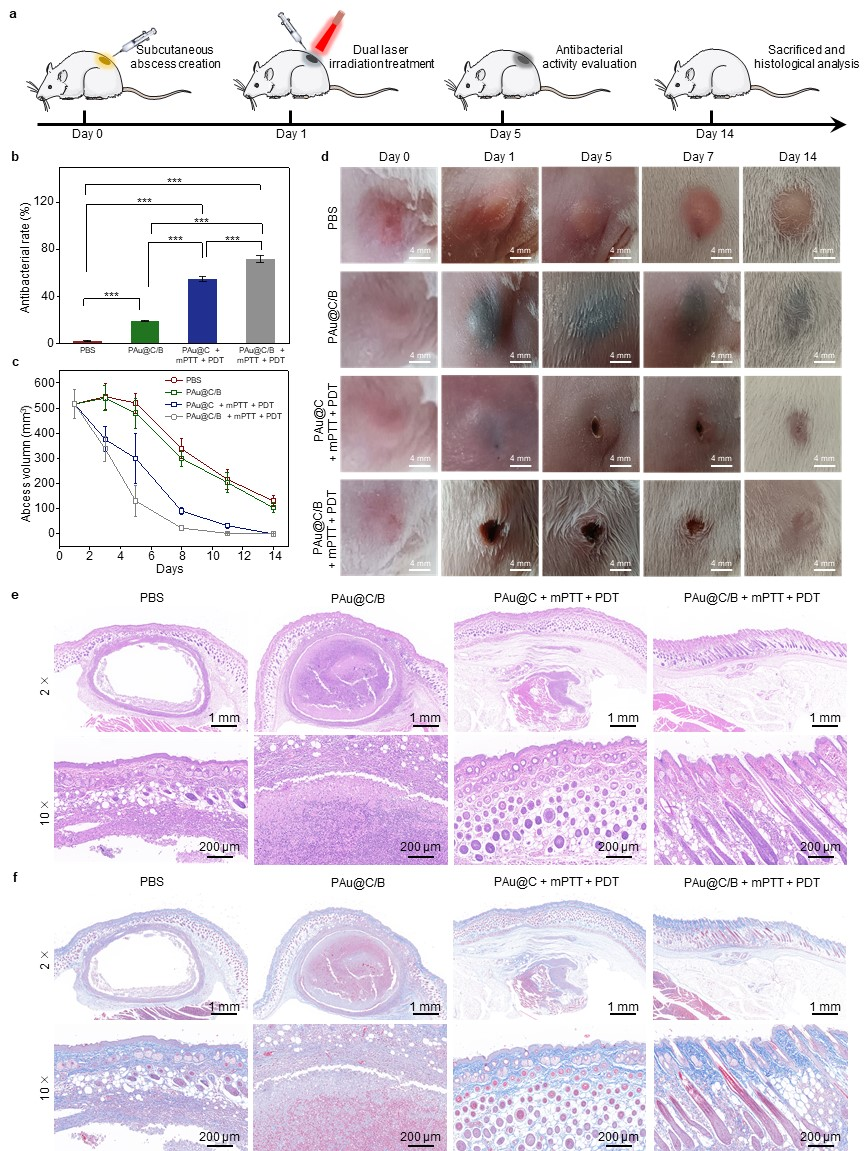
图5 复合金纳米花(PAu@C/B)在皮下脓肿模型的治疗效果
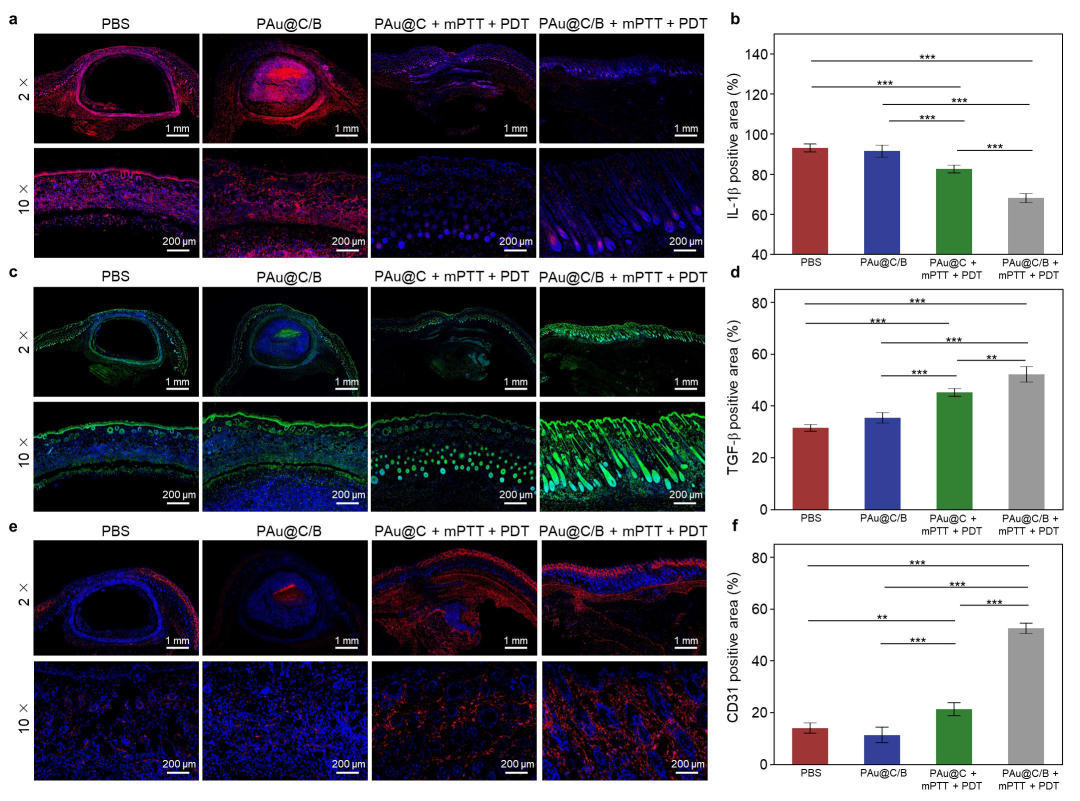
图6 复合金纳米花(PAu@C/B)治疗后免疫调节活性研究
相关研究成果近期以“Photo-triggered Multifunctional Gold-based Hybrid Nanoflowers Promote Infectious Skin Regeneration”为标题发表在学术期刊Chemical Engineering Journal上。海南大学李萌婷副教授、邓乔元副研究员、Griffith UniversityLan Xiao为共同通讯作者,海南大学硕士研究生洪季璇、朱嘉琪为共同第一作者。该研究得到了海南省青年基金(520QN224)、海南省重点研发国际合作项目(GHYF2022001)的支持。
原文链接:
https://www.sciencedirect.com/science/article/pii/S1385894724004224
 本科生工作咨询:0898-66255906
本科生工作咨询:0898-66255906 研究生工作咨询:0898-66256050
研究生工作咨询:0898-66256050 学科与科研工作咨询:0898-66279224
学科与科研工作咨询:0898-66279224 综合办公室:0898-66291383
综合办公室:0898-66291383 学院邮箱:hdhg@hainanu.edu.cn
学院邮箱:hdhg@hainanu.edu.cn 联系地址:海南大学化学化工学院
联系地址:海南大学化学化工学院